25.08.2023
Array
(
[ID] => 2319
[~ID] => 2319
[NAME] => Протокол методики микроинъекции эмбрионов рыб Данио-рерио (Zebrafish).
[~NAME] => Протокол методики микроинъекции эмбрионов рыб Данио-рерио (Zebrafish).
[IBLOCK_ID] => 14
[~IBLOCK_ID] => 14
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT] =>
Рыбы Данио-рерио - это стандартная биологическая модель, которая широко используется в экспериментах с микроинъекциями. Поскольку данный вид растет и развивается быстрее, чем любое млекопитающее, получить эмбрионы от него намного легче. Самым быстрым и надежным способом получения генномодифицированных или мутировавших видов Данио является введение фрагментов ДНК и РНК в их эмбрионы методом микроинъекции.
1. Материалы и Оборудование для проведения методики микроинъекций эмбрионов Данио-рерио
Материалы: эмбрионы Данио, питательная среда для эмбрионов, раствор агарозы, чашка Петри (10 см), камера, опытный образец для инъекций (например, ДНК / РНК), стеклянный капилляр, пипетка и т. д.
Оборудование: Микропипеточный пуллер, инъекционный насос для микроинъекций, микроманипулятор, устройство для стачивания кромок для микропипеток (при наличии), микроскоп, источник холодного света, инкубатор.
2. Процедура
2.1 Подготовка капилляра для микроинъекций
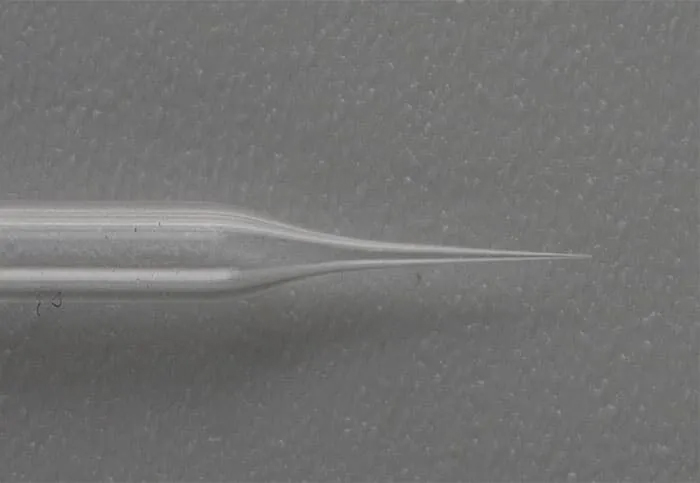
Подготовка подходящих инъекционных капилляров - первый шаг к успеху в методике микроинъекций эмбрионов зебрафиш. Микропипеточный пуллер от компании RWD предлагает к изготовлению капилляры, оптимизированные под требования пользователей.. Среднестатистическая длина конуса должна составлять около 8 мм. Микрокапилляр необходимо дополнительно заточить, чтобы получить более острый кончик, способствующий проникновению в эмбрион. Для этого существуют два распространенных метода: (1) с помощью небольшого пинцета отломить кончик и добиться диаметра кончика около 5-10 мкм или (2) поместить микрокапилляр в устройство для стачивания кромок . Затем медленно опустить иглу, чтобы она соприкасалась с шлифовальной пластиной под углом 45°. Наконечник готов к инъекции, когда он скошен.
2.2 Подготовка лунки для инъекций
a. Налейте 20 мл горячего 1,5%- раствора агарозы в чашку Петри диаметром 10 см. Подождите, пока он остынет.
b. Поместите пластиковую форму в еще чуть жидкий раствор.
c. После того, как агароза застынет, удалите форму, с помощью которой образовалось углубление. Добавьте соответствующее количество питательной среды. Затем накройте чашку крышкой, заверните в парафиновую пленку и храните при температуре 4°C для последующего использования.
2.3 Подготовка эмбрионов
a. За день до инъекции поместите Данио-рерио в аквариумы для разведения с перегородками в соотношении 1 самка к 1 самцу. На следующее утро снимите перегородки, чтобы дать возможность рыбам спариться и отложить икру.
b. Соберите эмбрионы и проверьте их развитие под микроскопом. Эмбрионы для инъекции должны находиться на одноклеточной стадии.
c. Промойте отобранные эмбрионы питательной средой, затем с помощью пипетки перенесите их в чашку Петри с лункой для инъекций.
d. Выровняйте эмбрионы по полярности клеток в лунке для инъекций (например, по зародышевому полюсу) как показано на рисунке.
e. Удалите излишки питательной среды из лунки для инъекций. Количество среды должно быть достаточным, чтобы покрыть эмбрионы. Это предотвратит всплытие эмбрионов или их прилипание к инъекционной игле во время инъекции и поможет игле проколоть поверхность хориона.
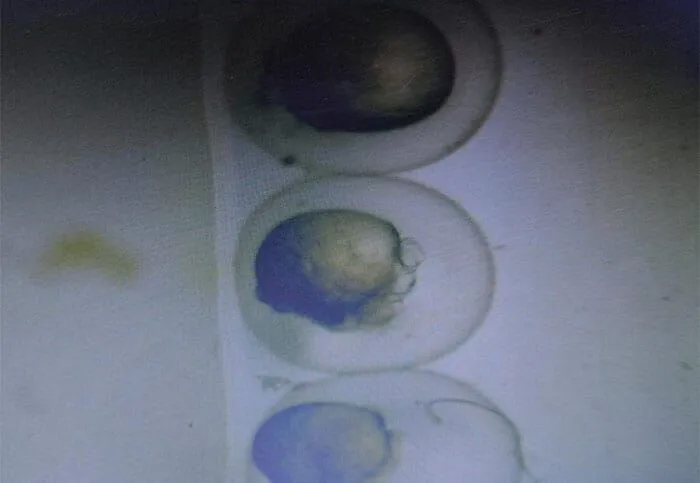
Рис. Наблюдение за выравниванием эмбрионов Данио под микроскопом по зародышевому полюсу.
2.4 Инъекция эмбриона
a. Вставьте пипетку с эмбрионом опытным образцом для инъекции в микроинъекционный насос. Установите насос на микроманипулятор и отрегулируйте угол наклона иглы приблизительно на 45° по отношению к поверхности инъекционной пластины.
b. Отрегулируйте положение инъекционной иглы с помощью элементов управления на микроманипуляторе, одновременно наблюдая за эмбрионами и кончиком иглы в поле зрения микроскопа для получения наиболее четкого обзора.
c. Переместите микроманипулятор, чтобы используя микроманипулятор введите капилляр с соответствующим количеством опытного образца провести электрод через хорион и желток в эмбрион. Введите соответствующее количество раствора для пробы в эмбрион. При использовании этого метода к опытному образцу для инъекции можно добавить соответствующее количество раствора фенолового красного, чтобы показать эффект после инъекции.
d. Медленно и равномерно извлеките инъекционную иглу из эмбриона и поднесите кончик иглы к следующему эмбриону для инъекции.
2.5 Культивирование эмбриональных клеток и наблюдение
a. Перенесите введенные инъецированные эмбрионы в чистую чашку Петри. Добавьте свежую питательную среду и инкубируйте их при температуре 28,5°C.
b. Наблюдайте за развитием эмбрионов под микроскопом, отбирайте мертвые эмбрионы (белые и флоккулирующие хлопьевидные под микроскопом) и эмбрионы с пороками развития (по мере наблюдения). В течение этого периода инкубации удаляйте все абортированные недоразвитые эмбрионы и регулярно заменяйте культуральную питательную среду.
3. Практические рекомендации Советы
a. Вставьте пипетку с опытным образцом для инъекции в микроинъекционный насос. Установите насос на микроманипулятор и отрегулируйте угол наклона иглы приблизительно на 45° по отношению к поверхности инъекционной пластины.
b. Отрегулируйте положение инъекционной иглы с помощью микроманипулятора, одновременно наблюдая за эмбрионами и кончиком иглы в плоскости поля микроскопа для получения наиболее четкой картинки.
c. Используя микроманипулятор введите капилляр с соответствующим количеством опытного образца через хорион и желток в эмбрион. При использовании этого метода к опытному образцу для инъекции можно добавить соответствующее количество раствора фенолового красного, чтобы показать эффект после инъекции.
d. Медленно и равномерно извлеките инъекционную иглу из эмбриона и поднесите кончик иглы к следующему эмбриону для инъекции.

MP500 - это горизонтальный микропипеточный пуллерсъемник микропипеток с электроприводом, предназначенный для изготовления (Вытягивания) микрокапилляров, которые широко используются при использовании методик пэтч-кламп (patch-clamp) и микроинъекций. того, чтобы сделать изготовление микропипеток воспроизводимым и простым.
Пуллер позволяет изготавливать по 2 симметричных капилляра за один раз диаметром менее 0,06 мкм и длиной конической части от 3 до 15 мм
[~DETAIL_TEXT] =>
Рыбы Данио-рерио - это стандартная биологическая модель, которая широко используется в экспериментах с микроинъекциями. Поскольку данный вид растет и развивается быстрее, чем любое млекопитающее, получить эмбрионы от него намного легче. Самым быстрым и надежным способом получения генномодифицированных или мутировавших видов Данио является введение фрагментов ДНК и РНК в их эмбрионы методом микроинъекции.
1. Материалы и Оборудование для проведения методики микроинъекций эмбрионов Данио-рерио
Материалы: эмбрионы Данио, питательная среда для эмбрионов, раствор агарозы, чашка Петри (10 см), камера, опытный образец для инъекций (например, ДНК / РНК), стеклянный капилляр, пипетка и т. д.
Оборудование: Микропипеточный пуллер, инъекционный насос для микроинъекций, микроманипулятор, устройство для стачивания кромок для микропипеток (при наличии), микроскоп, источник холодного света, инкубатор.
2. Процедура
2.1 Подготовка капилляра для микроинъекций
Подготовка подходящих инъекционных капилляров - первый шаг к успеху в методике микроинъекций эмбрионов зебрафиш. Микропипеточный пуллер от компании RWD предлагает к изготовлению капилляры, оптимизированные под требования пользователей.. Среднестатистическая длина конуса должна составлять около 8 мм. Микрокапилляр необходимо дополнительно заточить, чтобы получить более острый кончик, способствующий проникновению в эмбрион. Для этого существуют два распространенных метода: (1) с помощью небольшого пинцета отломить кончик и добиться диаметра кончика около 5-10 мкм или (2) поместить микрокапилляр в устройство для стачивания кромок . Затем медленно опустить иглу, чтобы она соприкасалась с шлифовальной пластиной под углом 45°. Наконечник готов к инъекции, когда он скошен.

2.2 Подготовка лунки для инъекций
a. Налейте 20 мл горячего 1,5%- раствора агарозы в чашку Петри диаметром 10 см. Подождите, пока он остынет.
b. Поместите пластиковую форму в еще чуть жидкий раствор.
c. После того, как агароза застынет, удалите форму, с помощью которой образовалось углубление. Добавьте соответствующее количество питательной среды. Затем накройте чашку крышкой, заверните в парафиновую пленку и храните при температуре 4°C для последующего использования.

2.3 Подготовка эмбрионов
a. За день до инъекции поместите Данио-рерио в аквариумы для разведения с перегородками в соотношении 1 самка к 1 самцу. На следующее утро снимите перегородки, чтобы дать возможность рыбам спариться и отложить икру.
b. Соберите эмбрионы и проверьте их развитие под микроскопом. Эмбрионы для инъекции должны находиться на одноклеточной стадии.
c. Промойте отобранные эмбрионы питательной средой, затем с помощью пипетки перенесите их в чашку Петри с лункой для инъекций.
d. Выровняйте эмбрионы по полярности клеток в лунке для инъекций (например, по зародышевому полюсу) как показано на рисунке.
e. Удалите излишки питательной среды из лунки для инъекций. Количество среды должно быть достаточным, чтобы покрыть эмбрионы. Это предотвратит всплытие эмбрионов или их прилипание к инъекционной игле во время инъекции и поможет игле проколоть поверхность хориона.

Рис. Наблюдение за выравниванием эмбрионов Данио под микроскопом по зародышевому полюсу.
2.4 Инъекция эмбриона
a. Вставьте пипетку с эмбрионом опытным образцом для инъекции в микроинъекционный насос. Установите насос на микроманипулятор и отрегулируйте угол наклона иглы приблизительно на 45° по отношению к поверхности инъекционной пластины.
b. Отрегулируйте положение инъекционной иглы с помощью элементов управления на микроманипуляторе, одновременно наблюдая за эмбрионами и кончиком иглы в поле зрения микроскопа для получения наиболее четкого обзора.
c. Переместите микроманипулятор, чтобы используя микроманипулятор введите капилляр с соответствующим количеством опытного образца провести электрод через хорион и желток в эмбрион. Введите соответствующее количество раствора для пробы в эмбрион. При использовании этого метода к опытному образцу для инъекции можно добавить соответствующее количество раствора фенолового красного, чтобы показать эффект после инъекции.
d. Медленно и равномерно извлеките инъекционную иглу из эмбриона и поднесите кончик иглы к следующему эмбриону для инъекции.
2.5 Культивирование эмбриональных клеток и наблюдение
a. Перенесите введенные инъецированные эмбрионы в чистую чашку Петри. Добавьте свежую питательную среду и инкубируйте их при температуре 28,5°C.
b. Наблюдайте за развитием эмбрионов под микроскопом, отбирайте мертвые эмбрионы (белые и флоккулирующие хлопьевидные под микроскопом) и эмбрионы с пороками развития (по мере наблюдения). В течение этого периода инкубации удаляйте все абортированные недоразвитые эмбрионы и регулярно заменяйте культуральную питательную среду.
3. Практические рекомендации Советы
a. Вставьте пипетку с опытным образцом для инъекции в микроинъекционный насос. Установите насос на микроманипулятор и отрегулируйте угол наклона иглы приблизительно на 45° по отношению к поверхности инъекционной пластины.
b. Отрегулируйте положение инъекционной иглы с помощью микроманипулятора, одновременно наблюдая за эмбрионами и кончиком иглы в плоскости поля микроскопа для получения наиболее четкой картинки.
c. Используя микроманипулятор введите капилляр с соответствующим количеством опытного образца через хорион и желток в эмбрион. При использовании этого метода к опытному образцу для инъекции можно добавить соответствующее количество раствора фенолового красного, чтобы показать эффект после инъекции.
d. Медленно и равномерно извлеките инъекционную иглу из эмбриона и поднесите кончик иглы к следующему эмбриону для инъекции.

MP500 - это горизонтальный микропипеточный пуллерсъемник микропипеток с электроприводом, предназначенный для изготовления (Вытягивания) микрокапилляров, которые широко используются при использовании методик пэтч-кламп (patch-clamp) и микроинъекций. того, чтобы сделать изготовление микропипеток воспроизводимым и простым.
Пуллер позволяет изготавливать по 2 симметричных капилляра за один раз диаметром менее 0,06 мкм и длиной конической части от 3 до 15 мм
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[DETAIL_PICTURE] => Array
(
[ID] => 5199
[TIMESTAMP_X] => 28.08.2023 10:16:13
[MODULE_ID] => iblock
[HEIGHT] => 600
[WIDTH] => 600
[FILE_SIZE] => 44306
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/abc/eo10dd7k8bvcs9k4ym956rnpxs7wqa0m
[FILE_NAME] => 12345.jpg
[ORIGINAL_NAME] => 12345.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => 4b28a45d2f23c6d889a82f812a867735
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/abc/eo10dd7k8bvcs9k4ym956rnpxs7wqa0m/12345.jpg
[UNSAFE_SRC] => /upload/iblock/abc/eo10dd7k8bvcs9k4ym956rnpxs7wqa0m/12345.jpg
[SAFE_SRC] => /upload/iblock/abc/eo10dd7k8bvcs9k4ym956rnpxs7wqa0m/12345.jpg
[ALT] => Протокол методики микроинъекции эмбрионов рыб Данио-рерио (Zebrafish).
[TITLE] => Протокол методики микроинъекции эмбрионов рыб Данио-рерио (Zebrafish).
)
[~DETAIL_PICTURE] => 5199
[TIMESTAMP_X] => 28.08.2023 10:16:13
[~TIMESTAMP_X] => 28.08.2023 10:16:13
[ACTIVE_FROM_X] => 2023-08-25 10:14:00
[~ACTIVE_FROM_X] => 2023-08-25 10:14:00
[ACTIVE_FROM] => 25.08.2023 10:14:00
[~ACTIVE_FROM] => 25.08.2023 10:14:00
[LIST_PAGE_URL] => /news.php
[~LIST_PAGE_URL] => /news.php
[DETAIL_PAGE_URL] => /news.php?ELEMENT_ID=2319
[~DETAIL_PAGE_URL] => /news.php?ELEMENT_ID=2319
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] =>
[~CODE] =>
[EXTERNAL_ID] => 2319
[~EXTERNAL_ID] => 2319
[IBLOCK_TYPE_ID] => news
[~IBLOCK_TYPE_ID] => news
[IBLOCK_CODE] => newsbga
[~IBLOCK_CODE] => newsbga
[IBLOCK_EXTERNAL_ID] =>
[~IBLOCK_EXTERNAL_ID] =>
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 25.08.2023
[IPROPERTY_VALUES] => Array
(
)
[FIELDS] => Array
(
)
[PROPERTIES] => Array
(
)
[DISPLAY_PROPERTIES] => Array
(
)
[IBLOCK] => Array
(
[ID] => 14
[~ID] => 14
[TIMESTAMP_X] => 23.02.2025 22:54:29
[~TIMESTAMP_X] => 23.02.2025 22:54:29
[IBLOCK_TYPE_ID] => news
[~IBLOCK_TYPE_ID] => news
[LID] => s1
[~LID] => s1
[CODE] => newsbga
[~CODE] => newsbga
[API_CODE] =>
[~API_CODE] =>
[NAME] => Новости БГА
[~NAME] => Новости БГА
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 10
[~SORT] => 10
[LIST_PAGE_URL] => /
[~LIST_PAGE_URL] => /
[DETAIL_PAGE_URL] => #SITE_DIR#/news.php?ELEMENT_ID=#ID#
[~DETAIL_PAGE_URL] => #SITE_DIR#/news.php?ELEMENT_ID=#ID#
[SECTION_PAGE_URL] =>
[~SECTION_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] =>
[~DESCRIPTION] =>
[DESCRIPTION_TYPE] => text
[~DESCRIPTION_TYPE] => text
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] =>
[~XML_ID] =>
[TMP_ID] =>
[~TMP_ID] =>
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => N
[~INDEX_SECTION] => N
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] =>
[~SECTIONS_NAME] =>
[SECTION_NAME] =>
[~SECTION_NAME] =>
[ELEMENTS_NAME] => Элементы
[~ELEMENTS_NAME] => Элементы
[ELEMENT_NAME] => Элемент
[~ELEMENT_NAME] => Элемент
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => N
[~SECTION_PROPERTY] => N
[PROPERTY_INDEX] => N
[~PROPERTY_INDEX] => N
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] =>
[~EXTERNAL_ID] =>
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => bga.su
[~SERVER_NAME] => bga.su
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => Протокол методики микроинъекции эмбрионов рыб Данио-рерио (Zebrafish).
[BROWSER_TITLE] =>
[KEYWORDS] =>
[DESCRIPTION] =>
)
)
1

Рыбы Данио-рерио - это стандартная биологическая модель, которая широко используется в экспериментах с микроинъекциями. Поскольку данный вид растет и развивается быстрее, чем любое млекопитающее, получить эмбрионы от него намного легче. Самым быстрым и надежным способом получения генномодифицированных или мутировавших видов Данио является введение фрагментов ДНК и РНК в их эмбрионы методом микроинъекции.
1. Материалы и Оборудование для проведения методики микроинъекций эмбрионов Данио-рерио
Материалы: эмбрионы Данио, питательная среда для эмбрионов, раствор агарозы, чашка Петри (10 см), камера, опытный образец для инъекций (например, ДНК / РНК), стеклянный капилляр, пипетка и т. д.
Оборудование: Микропипеточный пуллер, инъекционный насос для микроинъекций, микроманипулятор, устройство для стачивания кромок для микропипеток (при наличии), микроскоп, источник холодного света, инкубатор.
2. Процедура
2.1 Подготовка капилляра для микроинъекций
Подготовка подходящих инъекционных капилляров - первый шаг к успеху в методике микроинъекций эмбрионов зебрафиш. Микропипеточный пуллер от компании RWD предлагает к изготовлению капилляры, оптимизированные под требования пользователей.. Среднестатистическая длина конуса должна составлять около 8 мм. Микрокапилляр необходимо дополнительно заточить, чтобы получить более острый кончик, способствующий проникновению в эмбрион. Для этого существуют два распространенных метода: (1) с помощью небольшого пинцета отломить кончик и добиться диаметра кончика около 5-10 мкм или (2) поместить микрокапилляр в устройство для стачивания кромок . Затем медленно опустить иглу, чтобы она соприкасалась с шлифовальной пластиной под углом 45°. Наконечник готов к инъекции, когда он скошен.

2.2 Подготовка лунки для инъекций
a. Налейте 20 мл горячего 1,5%- раствора агарозы в чашку Петри диаметром 10 см. Подождите, пока он остынет.
b. Поместите пластиковую форму в еще чуть жидкий раствор.
c. После того, как агароза застынет, удалите форму, с помощью которой образовалось углубление. Добавьте соответствующее количество питательной среды. Затем накройте чашку крышкой, заверните в парафиновую пленку и храните при температуре 4°C для последующего использования.

2.3 Подготовка эмбрионов
a. За день до инъекции поместите Данио-рерио в аквариумы для разведения с перегородками в соотношении 1 самка к 1 самцу. На следующее утро снимите перегородки, чтобы дать возможность рыбам спариться и отложить икру.
b. Соберите эмбрионы и проверьте их развитие под микроскопом. Эмбрионы для инъекции должны находиться на одноклеточной стадии.
c. Промойте отобранные эмбрионы питательной средой, затем с помощью пипетки перенесите их в чашку Петри с лункой для инъекций.
d. Выровняйте эмбрионы по полярности клеток в лунке для инъекций (например, по зародышевому полюсу) как показано на рисунке.
e. Удалите излишки питательной среды из лунки для инъекций. Количество среды должно быть достаточным, чтобы покрыть эмбрионы. Это предотвратит всплытие эмбрионов или их прилипание к инъекционной игле во время инъекции и поможет игле проколоть поверхность хориона.

Рис. Наблюдение за выравниванием эмбрионов Данио под микроскопом по зародышевому полюсу.
2.4 Инъекция эмбриона
a. Вставьте пипетку с эмбрионом опытным образцом для инъекции в микроинъекционный насос. Установите насос на микроманипулятор и отрегулируйте угол наклона иглы приблизительно на 45° по отношению к поверхности инъекционной пластины.
b. Отрегулируйте положение инъекционной иглы с помощью элементов управления на микроманипуляторе, одновременно наблюдая за эмбрионами и кончиком иглы в поле зрения микроскопа для получения наиболее четкого обзора.
c. Переместите микроманипулятор, чтобы используя микроманипулятор введите капилляр с соответствующим количеством опытного образца провести электрод через хорион и желток в эмбрион. Введите соответствующее количество раствора для пробы в эмбрион. При использовании этого метода к опытному образцу для инъекции можно добавить соответствующее количество раствора фенолового красного, чтобы показать эффект после инъекции.
d. Медленно и равномерно извлеките инъекционную иглу из эмбриона и поднесите кончик иглы к следующему эмбриону для инъекции.
2.5 Культивирование эмбриональных клеток и наблюдение
a. Перенесите введенные инъецированные эмбрионы в чистую чашку Петри. Добавьте свежую питательную среду и инкубируйте их при температуре 28,5°C.
b. Наблюдайте за развитием эмбрионов под микроскопом, отбирайте мертвые эмбрионы (белые и флоккулирующие хлопьевидные под микроскопом) и эмбрионы с пороками развития (по мере наблюдения). В течение этого периода инкубации удаляйте все абортированные недоразвитые эмбрионы и регулярно заменяйте культуральную питательную среду.
3. Практические рекомендации Советы
a. Вставьте пипетку с опытным образцом для инъекции в микроинъекционный насос. Установите насос на микроманипулятор и отрегулируйте угол наклона иглы приблизительно на 45° по отношению к поверхности инъекционной пластины.
b. Отрегулируйте положение инъекционной иглы с помощью микроманипулятора, одновременно наблюдая за эмбрионами и кончиком иглы в плоскости поля микроскопа для получения наиболее четкой картинки.
c. Используя микроманипулятор введите капилляр с соответствующим количеством опытного образца через хорион и желток в эмбрион. При использовании этого метода к опытному образцу для инъекции можно добавить соответствующее количество раствора фенолового красного, чтобы показать эффект после инъекции.
d. Медленно и равномерно извлеките инъекционную иглу из эмбриона и поднесите кончик иглы к следующему эмбриону для инъекции.

MP500 - это горизонтальный микропипеточный пуллерсъемник микропипеток с электроприводом, предназначенный для изготовления (Вытягивания) микрокапилляров, которые широко используются при использовании методик пэтч-кламп (patch-clamp) и микроинъекций. того, чтобы сделать изготовление микропипеток воспроизводимым и простым.
Пуллер позволяет изготавливать по 2 симметричных капилляра за один раз диаметром менее 0,06 мкм и длиной конической части от 3 до 15 мм






