У нас юбилей!

Array
(
[ID] => 2225
[~ID] => 2225
[NAME] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[~NAME] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[IBLOCK_ID] => 14
[~IBLOCK_ID] => 14
[IBLOCK_SECTION_ID] =>
[~IBLOCK_SECTION_ID] =>
[DETAIL_TEXT] =>
Независимо от того, готовитесь ли вы к своему первому эксперименту по ПЦР в реальном времени или являетесь опытным экспертом, когда дело доходит до совершенствования ПЦР-анализы в реальном времени позволяют каждому добиться максимального успеха. Проверьте свои знания в области ОТ-ПЦР и рассмотрите эти важные советы, основанные на экспертном опыте.
• Начинающий • Средний • Продвинутый • Эксперт
1. СОЗДАВАЙТЕ ОТЛИЧНЫЕ ПРАЙМЕРЫ И ЗОНДЫ
• Определите свой эталонный ген; отличные праймеры могут уже существовать.
• Целевой размер ампликона = 70-150 п.н.
• Охватывать соединение экзон-экзон
• Содержание ГЦ = 40-60%
• Tm = 50-65°C
• Ограничьте количество идентичных последовательностей нуклеотидов.
• Проверка специфичности с помощью Праймер-ВЗРЫВА
• Обеспечьте минимальное количество вторичных структур и предотвратите образование димер праймера.
• Оптимизируйте Ta с помощью температурного градиента на устройстве qPCR
• Используйте онлайн-инструмент, такой как PrimerQuest ® IDT, для разработки конкретных комбинаций праймера и зонда.
• Храните исходные олигонуклеотиды (100 мкМ) и разбавленные аликвоты (10–20 мкМ) в не содержащей нуклеаз H2O при температуре -20°C
2. ВЫДЕЛИТЕ ВЫСОКОКАЧЕСТВЕННУЮ РНК
• РНК очень чувствительна к деградации; используйте СИЗ, убедитесь, что все инструменты и рабочая зона стерилизованы H2O2, и храните образцы на льду
• Обеспечьте высокое качество РНК (соотношение 260/280 1,8–2,0; в идеале 2,0) количество (варьируется), прежде чем приступить к синтезу кДНК
• Если вас беспокоит качество, нанесите РНК на гель; размазывание в отличие от двух чистых полос (2:1) указывает на низкое качество
• Обработайте ДНКазой для удаления загрязнений из геномной ДНК (гДНК) перед синтезом кДНК
3. УТОЧНИТЕ КОЛИЧЕСТВО ШАБЛОНОВ И ЭФФЕКТИВНОСТЬ РЕАКЦИИ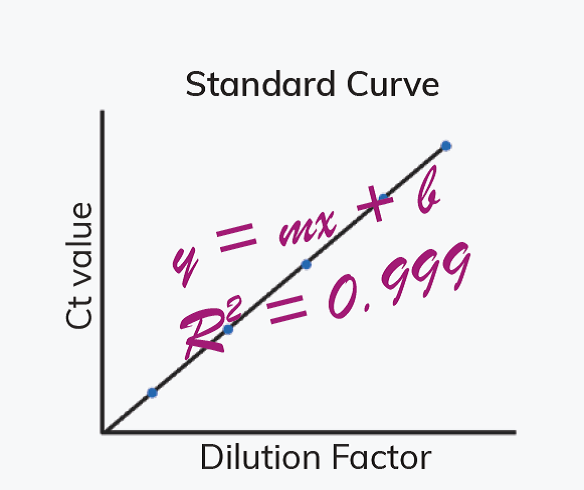
• Перед использованием перемешайте и быстро закрутите все реагенты, убедившись, что при необходимости используйте пипетку малого объема (например, P10).
• Последовательно разбавлять шаблонную кДНК для определения разведения, которое дает идеальный порог цикла (Ct) значения 20-30
• Проверьте эффективность реакции [10(-1/наклон)-1]*100% и R2 > 0,95 по стандартной кривой для всех пар праймеров; всегда используйте свежие растворы
• Совместная проверка мультиплексированных анализов
4. ВКЛЮЧАЙТЕ ПРАВИЛЬНЫЕ СРЕДСТВА УПРАВЛЕНИЯ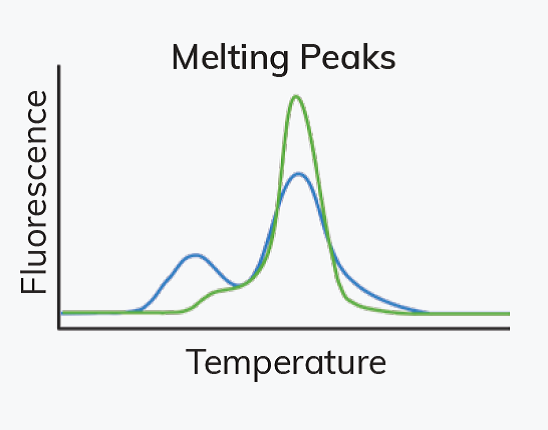
• Контроль отсутствия шаблонов (NTC) определит, присутствует ли загрязнение в вашей основной смеси.
• Положительный контроль гарантирует соблюдение условий реакции и помогает определить, работают ли ваши новые праймеры / зонды.
• Контроль отсутствия обратной транскриптазы (RT) определит, есть ли у вас Загрязнители ДНК (например, из gDNA)
• Для анализов на основе SYBR® используйте кривую плавления в конце цикла, чтобы определить, что только один продукт амплифицируется
• Внутренний положительный контроль определит наличие ингибиторов ПЦР
5. ВЫБЕРИТЕ ПОДХОДЯЩИЙМЕТОД АНАЛИЗА Ct: ПОРОГ VS РЕГРЕССИЯ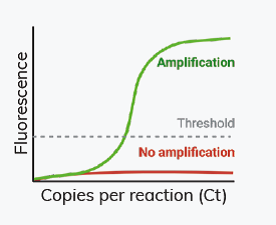
• Убедитесь, что условия циклирования верны (особенно при использовании общего устройства)
• Режим регрессионного анализа установлен по умолчанию на многих устройствах qPCR
• Для порогового анализа установите базовую уровень на два цикла раньше, чем значение Ct для наиболее обильного образца; пороговое значение должно быть установлено на фазу экспоненциального роста продукта.
[~DETAIL_TEXT] =>
Независимо от того, готовитесь ли вы к своему первому эксперименту по ПЦР в реальном времени или являетесь опытным экспертом, когда дело доходит до совершенствования ПЦР-анализы в реальном времени позволяют каждому добиться максимального успеха. Проверьте свои знания в области ОТ-ПЦР и рассмотрите эти важные советы, основанные на экспертном опыте.
• Начинающий • Средний • Продвинутый • Эксперт
1. СОЗДАВАЙТЕ ОТЛИЧНЫЕ ПРАЙМЕРЫ И ЗОНДЫ
• Определите свой эталонный ген; отличные праймеры могут уже существовать.
• Целевой размер ампликона = 70-150 п.н.
• Охватывать соединение экзон-экзон
• Содержание ГЦ = 40-60%
• Tm = 50-65°C
• Ограничьте количество идентичных последовательностей нуклеотидов.
• Проверка специфичности с помощью Праймер-ВЗРЫВА
• Обеспечьте минимальное количество вторичных структур и предотвратите образование димер праймера.
• Оптимизируйте Ta с помощью температурного градиента на устройстве qPCR
• Используйте онлайн-инструмент, такой как PrimerQuest ® IDT, для разработки конкретных комбинаций праймера и зонда.
• Храните исходные олигонуклеотиды (100 мкМ) и разбавленные аликвоты (10–20 мкМ) в не содержащей нуклеаз H2O при температуре -20°C
2. ВЫДЕЛИТЕ ВЫСОКОКАЧЕСТВЕННУЮ РНК

• РНК очень чувствительна к деградации; используйте СИЗ, убедитесь, что все инструменты и рабочая зона стерилизованы H2O2, и храните образцы на льду
• Обеспечьте высокое качество РНК (соотношение 260/280 1,8–2,0; в идеале 2,0) количество (варьируется), прежде чем приступить к синтезу кДНК
• Если вас беспокоит качество, нанесите РНК на гель; размазывание в отличие от двух чистых полос (2:1) указывает на низкое качество
• Обработайте ДНКазой для удаления загрязнений из геномной ДНК (гДНК) перед синтезом кДНК
3. УТОЧНИТЕ КОЛИЧЕСТВО ШАБЛОНОВ И ЭФФЕКТИВНОСТЬ РЕАКЦИИ
• Перед использованием перемешайте и быстро закрутите все реагенты, убедившись, что при необходимости используйте пипетку малого объема (например, P10).
• Последовательно разбавлять шаблонную кДНК для определения разведения, которое дает идеальный порог цикла (Ct) значения 20-30
• Проверьте эффективность реакции [10(-1/наклон)-1]*100% и R2 > 0,95 по стандартной кривой для всех пар праймеров; всегда используйте свежие растворы
• Совместная проверка мультиплексированных анализов
4. ВКЛЮЧАЙТЕ ПРАВИЛЬНЫЕ СРЕДСТВА УПРАВЛЕНИЯ
• Контроль отсутствия шаблонов (NTC) определит, присутствует ли загрязнение в вашей основной смеси.
• Положительный контроль гарантирует соблюдение условий реакции и помогает определить, работают ли ваши новые праймеры / зонды.
• Контроль отсутствия обратной транскриптазы (RT) определит, есть ли у вас Загрязнители ДНК (например, из gDNA)
• Для анализов на основе SYBR® используйте кривую плавления в конце цикла, чтобы определить, что только один продукт амплифицируется
• Внутренний положительный контроль определит наличие ингибиторов ПЦР
5. ВЫБЕРИТЕ ПОДХОДЯЩИЙМЕТОД АНАЛИЗА Ct: ПОРОГ VS РЕГРЕССИЯ
• Убедитесь, что условия циклирования верны (особенно при использовании общего устройства)
• Режим регрессионного анализа установлен по умолчанию на многих устройствах qPCR
• Для порогового анализа установите базовую уровень на два цикла раньше, чем значение Ct для наиболее обильного образца; пороговое значение должно быть установлено на фазу экспоненциального роста продукта.
[DETAIL_TEXT_TYPE] => html
[~DETAIL_TEXT_TYPE] => html
[PREVIEW_TEXT] =>
[~PREVIEW_TEXT] =>
[PREVIEW_TEXT_TYPE] => text
[~PREVIEW_TEXT_TYPE] => text
[DETAIL_PICTURE] => Array
(
[ID] => 4724
[TIMESTAMP_X] => 01.04.2022 12:24:21
[MODULE_ID] => iblock
[HEIGHT] => 51
[WIDTH] => 220
[FILE_SIZE] => 2669
[CONTENT_TYPE] => image/jpeg
[SUBDIR] => iblock/788/sq729xjo28s115hjqndn93ee9ey1sctg
[FILE_NAME] => Азуре имеджер.jpg
[ORIGINAL_NAME] => Азуре имеджер.jpg
[DESCRIPTION] =>
[HANDLER_ID] =>
[EXTERNAL_ID] => f84f6e8efacc36f8fac0902e212a63f0
[VERSION_ORIGINAL_ID] =>
[META] =>
[SRC] => /upload/iblock/788/sq729xjo28s115hjqndn93ee9ey1sctg/%D0%90%D0%B7%D1%83%D1%80%D0%B5%20%D0%B8%D0%BC%D0%B5%D0%B4%D0%B6%D0%B5%D1%80.jpg
[UNSAFE_SRC] => /upload/iblock/788/sq729xjo28s115hjqndn93ee9ey1sctg/Азуре имеджер.jpg
[SAFE_SRC] => /upload/iblock/788/sq729xjo28s115hjqndn93ee9ey1sctg/%D0%90%D0%B7%D1%83%D1%80%D0%B5%20%D0%B8%D0%BC%D0%B5%D0%B4%D0%B6%D0%B5%D1%80.jpg
[ALT] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[TITLE] => 5 Основных советов для успешного проведения ПЦР в реальном времени
)
[~DETAIL_PICTURE] => 4724
[TIMESTAMP_X] => 01.04.2022 12:24:21
[~TIMESTAMP_X] => 01.04.2022 12:24:21
[ACTIVE_FROM_X] => 2022-04-01 11:04:00
[~ACTIVE_FROM_X] => 2022-04-01 11:04:00
[ACTIVE_FROM] => 01.04.2022 11:04:00
[~ACTIVE_FROM] => 01.04.2022 11:04:00
[LIST_PAGE_URL] => /news.php
[~LIST_PAGE_URL] => /news.php
[DETAIL_PAGE_URL] => /news.php?ELEMENT_ID=2225
[~DETAIL_PAGE_URL] => /news.php?ELEMENT_ID=2225
[LANG_DIR] => /
[~LANG_DIR] => /
[CODE] =>
[~CODE] =>
[EXTERNAL_ID] => 2225
[~EXTERNAL_ID] => 2225
[IBLOCK_TYPE_ID] => news
[~IBLOCK_TYPE_ID] => news
[IBLOCK_CODE] => newsbga
[~IBLOCK_CODE] => newsbga
[IBLOCK_EXTERNAL_ID] =>
[~IBLOCK_EXTERNAL_ID] =>
[LID] => s1
[~LID] => s1
[NAV_RESULT] =>
[NAV_CACHED_DATA] =>
[DISPLAY_ACTIVE_FROM] => 01.04.2022
[IPROPERTY_VALUES] => Array
(
[ELEMENT_META_TITLE] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[ELEMENT_META_KEYWORDS] => 5 Основных советов для успешного проведения ПЦР в реальном времени, ПЦР в реальном времени, ПЦР
[ELEMENT_META_DESCRIPTION] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[ELEMENT_PAGE_TITLE] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[ELEMENT_PREVIEW_PICTURE_FILE_ALT] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[ELEMENT_PREVIEW_PICTURE_FILE_TITLE] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[ELEMENT_PREVIEW_PICTURE_FILE_NAME] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[ELEMENT_DETAIL_PICTURE_FILE_ALT] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[ELEMENT_DETAIL_PICTURE_FILE_TITLE] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[ELEMENT_DETAIL_PICTURE_FILE_NAME] => 5osnovnykhsovetovdlyauspeshnogoprovedeniyaptsrvrealnomvremeni
)
[FIELDS] => Array
(
)
[PROPERTIES] => Array
(
)
[DISPLAY_PROPERTIES] => Array
(
)
[IBLOCK] => Array
(
[ID] => 14
[~ID] => 14
[TIMESTAMP_X] => 23.02.2025 22:54:29
[~TIMESTAMP_X] => 23.02.2025 22:54:29
[IBLOCK_TYPE_ID] => news
[~IBLOCK_TYPE_ID] => news
[LID] => s1
[~LID] => s1
[CODE] => newsbga
[~CODE] => newsbga
[API_CODE] =>
[~API_CODE] =>
[NAME] => Новости БГА
[~NAME] => Новости БГА
[ACTIVE] => Y
[~ACTIVE] => Y
[SORT] => 10
[~SORT] => 10
[LIST_PAGE_URL] => /
[~LIST_PAGE_URL] => /
[DETAIL_PAGE_URL] => #SITE_DIR#/news.php?ELEMENT_ID=#ID#
[~DETAIL_PAGE_URL] => #SITE_DIR#/news.php?ELEMENT_ID=#ID#
[SECTION_PAGE_URL] =>
[~SECTION_PAGE_URL] =>
[PICTURE] =>
[~PICTURE] =>
[DESCRIPTION] =>
[~DESCRIPTION] =>
[DESCRIPTION_TYPE] => text
[~DESCRIPTION_TYPE] => text
[RSS_TTL] => 24
[~RSS_TTL] => 24
[RSS_ACTIVE] => Y
[~RSS_ACTIVE] => Y
[RSS_FILE_ACTIVE] => N
[~RSS_FILE_ACTIVE] => N
[RSS_FILE_LIMIT] =>
[~RSS_FILE_LIMIT] =>
[RSS_FILE_DAYS] =>
[~RSS_FILE_DAYS] =>
[RSS_YANDEX_ACTIVE] => N
[~RSS_YANDEX_ACTIVE] => N
[XML_ID] =>
[~XML_ID] =>
[TMP_ID] =>
[~TMP_ID] =>
[INDEX_ELEMENT] => Y
[~INDEX_ELEMENT] => Y
[INDEX_SECTION] => N
[~INDEX_SECTION] => N
[WORKFLOW] => N
[~WORKFLOW] => N
[BIZPROC] => N
[~BIZPROC] => N
[SECTION_CHOOSER] => L
[~SECTION_CHOOSER] => L
[LIST_MODE] =>
[~LIST_MODE] =>
[VERSION] => 1
[~VERSION] => 1
[LAST_CONV_ELEMENT] => 0
[~LAST_CONV_ELEMENT] => 0
[SOCNET_GROUP_ID] =>
[~SOCNET_GROUP_ID] =>
[EDIT_FILE_BEFORE] =>
[~EDIT_FILE_BEFORE] =>
[EDIT_FILE_AFTER] =>
[~EDIT_FILE_AFTER] =>
[SECTIONS_NAME] =>
[~SECTIONS_NAME] =>
[SECTION_NAME] =>
[~SECTION_NAME] =>
[ELEMENTS_NAME] => Элементы
[~ELEMENTS_NAME] => Элементы
[ELEMENT_NAME] => Элемент
[~ELEMENT_NAME] => Элемент
[RIGHTS_MODE] => S
[~RIGHTS_MODE] => S
[SECTION_PROPERTY] => N
[~SECTION_PROPERTY] => N
[PROPERTY_INDEX] => N
[~PROPERTY_INDEX] => N
[CANONICAL_PAGE_URL] =>
[~CANONICAL_PAGE_URL] =>
[REST_ON] => N
[~REST_ON] => N
[EXTERNAL_ID] =>
[~EXTERNAL_ID] =>
[LANG_DIR] => /
[~LANG_DIR] => /
[SERVER_NAME] => bga.su
[~SERVER_NAME] => bga.su
)
[SECTION] => Array
(
[PATH] => Array
(
)
)
[SECTION_URL] =>
[META_TAGS] => Array
(
[TITLE] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[BROWSER_TITLE] => 5 Основных советов для успешного проведения ПЦР в реальном времени
[KEYWORDS] => 5 Основных советов для успешного проведения ПЦР в реальном времени, ПЦР в реальном времени, ПЦР
[DESCRIPTION] => 5 Основных советов для успешного проведения ПЦР в реальном времени
)
)
1

Независимо от того, готовитесь ли вы к своему первому эксперименту по ПЦР в реальном времени или являетесь опытным экспертом, когда дело доходит до совершенствования ПЦР-анализы в реальном времени позволяют каждому добиться максимального успеха. Проверьте свои знания в области ОТ-ПЦР и рассмотрите эти важные советы, основанные на экспертном опыте.
• Начинающий • Средний • Продвинутый • Эксперт
1. СОЗДАВАЙТЕ ОТЛИЧНЫЕ ПРАЙМЕРЫ И ЗОНДЫ
• Определите свой эталонный ген; отличные праймеры могут уже существовать.
• Целевой размер ампликона = 70-150 п.н.
• Охватывать соединение экзон-экзон
• Содержание ГЦ = 40-60%
• Tm = 50-65°C
• Ограничьте количество идентичных последовательностей нуклеотидов.
• Проверка специфичности с помощью Праймер-ВЗРЫВА
• Обеспечьте минимальное количество вторичных структур и предотвратите образование димер праймера.
• Оптимизируйте Ta с помощью температурного градиента на устройстве qPCR
• Используйте онлайн-инструмент, такой как PrimerQuest ® IDT, для разработки конкретных комбинаций праймера и зонда.
• Храните исходные олигонуклеотиды (100 мкМ) и разбавленные аликвоты (10–20 мкМ) в не содержащей нуклеаз H2O при температуре -20°C
2. ВЫДЕЛИТЕ ВЫСОКОКАЧЕСТВЕННУЮ РНК

• РНК очень чувствительна к деградации; используйте СИЗ, убедитесь, что все инструменты и рабочая зона стерилизованы H2O2, и храните образцы на льду
• Обеспечьте высокое качество РНК (соотношение 260/280 1,8–2,0; в идеале 2,0) количество (варьируется), прежде чем приступить к синтезу кДНК
• Если вас беспокоит качество, нанесите РНК на гель; размазывание в отличие от двух чистых полос (2:1) указывает на низкое качество
• Обработайте ДНКазой для удаления загрязнений из геномной ДНК (гДНК) перед синтезом кДНК
3. УТОЧНИТЕ КОЛИЧЕСТВО ШАБЛОНОВ И ЭФФЕКТИВНОСТЬ РЕАКЦИИ
• Перед использованием перемешайте и быстро закрутите все реагенты, убедившись, что при необходимости используйте пипетку малого объема (например, P10).
• Последовательно разбавлять шаблонную кДНК для определения разведения, которое дает идеальный порог цикла (Ct) значения 20-30
• Проверьте эффективность реакции [10(-1/наклон)-1]*100% и R2 > 0,95 по стандартной кривой для всех пар праймеров; всегда используйте свежие растворы
• Совместная проверка мультиплексированных анализов
4. ВКЛЮЧАЙТЕ ПРАВИЛЬНЫЕ СРЕДСТВА УПРАВЛЕНИЯ
• Контроль отсутствия шаблонов (NTC) определит, присутствует ли загрязнение в вашей основной смеси.
• Положительный контроль гарантирует соблюдение условий реакции и помогает определить, работают ли ваши новые праймеры / зонды.
• Контроль отсутствия обратной транскриптазы (RT) определит, есть ли у вас Загрязнители ДНК (например, из gDNA)
• Для анализов на основе SYBR® используйте кривую плавления в конце цикла, чтобы определить, что только один продукт амплифицируется
• Внутренний положительный контроль определит наличие ингибиторов ПЦР
5. ВЫБЕРИТЕ ПОДХОДЯЩИЙМЕТОД АНАЛИЗА Ct: ПОРОГ VS РЕГРЕССИЯ
• Убедитесь, что условия циклирования верны (особенно при использовании общего устройства)
• Режим регрессионного анализа установлен по умолчанию на многих устройствах qPCR
• Для порогового анализа установите базовую уровень на два цикла раньше, чем значение Ct для наиболее обильного образца; пороговое значение должно быть установлено на фазу экспоненциального роста продукта.

